- Steinman RM, et al. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med 1973; 137: 1142-1162.
- Banchereau J, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000; 18: 767-811.
- Villadangos JA, et al. Intrinsic and cooperative antigen-presenting functions of dendritic-cell subsets in vivo. Nat Rev Immunol 2007; 7: 543-555.
- Nagayama H, Sato K, Yamashita N, et al. Results of a phase I clinical study using autologous tumour lysate-pulsed monocyte-derived mature dendritic cell vaccinations for stage IV malignant melanoma patients combined with low dose interleukin-2. Melanoma Res 2003; 13: 521-530.
- Kuwabara K, Nishishita T, Yamashita N, et al. Results of a phase I clinical study using dendritic cell vaccinations for thyroid cancer. Thyroid 2007; 17: 53-58.
- Sugiyama H. Wilms’ tumor gene WT1: its oncogenic function and clinical application. Int J Hematol 2001; 73: 177-187.
- Tsuboi A, Sugiyama H, et al. Enhanced induction of human WT1-specific cytotoxic T lymphocytes with a 9-mer WT1 peptide modified at HLA-A*2402-binding residues. Cancer Immunol Immunother 2002; 51: 614-620
- Cheever MA, et al. The prioritization of cancer antigens: a National Cancer Institute pilot project for the acceleration of translational research. Clin Cancer Res 2009; 15: 5323–5337.
- Kimura Y, Okamoto M, et al. Clinical and immunologic evaluation of dendritic cell-based immunotherapy in combination sith gemcitabine and/or S-1 in patients with advanced pancreatic carcinoma. Pancreas 2012; 41: 195-205.
- Takahashi H, Yonemitsu Y, et al. Impact of dendritic cell vaccines pulsed with Wilms’ tomour-1 peptide antigen on the survival of patients with advanced non-small cell lung cancers. Eur J Cancer 2013; 49: 852-859.
- Kobayashi M, et al. Dendritic cell-based immunotherapy targeting synthesized peptides for advanced biliary tract cancer. J Gastrointest Surg 2013; 17: 1609-1617.
- Kobayashi M, et al. Prognostic factors related to add-on dendritic cell vaccines on patients with inoperable pancreatic cancer receiving chemotherapy: a multicenter analysis. Cancer Immunol Immunother 2014; 63: 797-806.
- Kobayashi M, et al. The feasibility and clinical effects of dendritic cell-based immunotherapy targeting synthesized peptides for recurrent ovarian cancer. J Ovarian Res 2014; 7: 48.
- Kobayashi M, et al. Therapeutic effect of intratumoral injections of dendritic cells for locally recurrent gastric cancer: a case report. World J Surg Oncol 2014; 12: 390.
- Koido S, Homma S, et al. Treatment with chemotherapy and dendritic cells pulsed with multiple Wilms’tomor 1 (WT1)-specific MHC class I/II-restricted epitopes for pancreatic cancer. Clin Cancer Res. 2014; 20: 4228-4239.
- Kantoff PW, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med. 2010; 363: 411-422.
銘煌CITクリニック|がん検査・予防・治療・アンチエイジング
TREATMENT
治療
がん先進治療
当院では、がんの免疫療法と水素吸入療法を自由診療でご提供しております。
医療相談(初回無料)を随時行っております。十分お時間をとって丁寧にお話を伺わせて頂きます。
ご自身のことやご家族・ご友人のことでお悩みの際は、まずはお気軽にご遠慮なくご相談下さい。

樹状細胞ワクチン療法
免疫系の“司令塔”と呼ばれる樹状細胞を大量に培養してがんの目印である「がん抗原」を取り込ませた形にして皮内に投与すると、樹状細胞は体内で“兵隊”の役割を果たすTリンパ球に「がん抗原」を教育します。樹状細胞によって活性化されてがん細胞を攻撃できる能力を持つようになったTリンパ球が、体内のがん細胞を見つけて標的として殺傷する治療です。

樹状細胞ワクチン療法

樹状細胞
厚生労働省関東信越厚生局 認可2018年11月8日 更新2020年2月4日:再生医療等提供計画番号PC3180169 厚生労働省関東信越厚生局 認可2018年1月7日:再生医療等提供計画番号PC3190177
免疫系の“司令塔”と呼ばれる樹状細胞を大量に培養してがんの目印である「がん抗原」を取り込ませた形にして皮内に投与すると、樹状細胞は体内で“兵隊”の役割を果たすTリンパ球に「がん抗原」を教育します。樹状細胞によって活性化されてがん細胞を攻撃できる能力を持つようになったTリンパ球が、体内のがん細胞を見つけて標的として殺傷する治療です。 血液中の白血球の一種である単球を大量に集めて、培養して樹状細胞に分化させます。単球は培養しても分裂して増えないため、最初に大量に集める必要があり、血液を循環させながら白血球だけを集める「アフェレーシス」という処置を一日だけお受け頂くことが必要になります。
単球を培養して樹状細胞ができたら、患者様の白血球型とがんの種類に合わせて「がん抗原ペプチド」を選択し、これを樹状細胞に取り込ませて、1,000万個で樹状細胞ワクチン1本として液体窒素に凍結保存し、2~3週間に1回程度の頻度で1本ずつ皮内注射をして、抗がん免疫を増強してゆきます。
◆2016年12月、テラファーマ株式会社が和歌山県立医大と進行した膵臓がんに対するWT1ペプチドパルス樹状細胞ワクチンの安全性と有効性を検討する本邦初となる医師主導治験の計画書を独立行政法人 医薬品医療機器総合機構(PMDA)に申請し、2017年3月に二重盲検ランダム化比較試験が開始されました。中間解析の結果、その安全性が確認され、さらに多施設共同研究に展開してその有効性の評価が行われる次の段階に進んでおります(UMIN試験ID:UMIN000027179)。[2022年11月現在]
◆がんの樹状細胞ワクチン療法を詳しくお知りになりたい患者様は医療相談(初回無料)を随時行っておりますのでお電話やインターネットでご予約の上、お気軽にご相談下さい。

◆患者様の大切な樹状細胞ワクチンは当院の液体窒素タンクで凍結保管致します。樹状細胞ワクチンの投与の際には、当院内に完備された安全キャビネット内で無菌的かつ迅速に解凍作業を行い、直ちに患者様に投与されます。
樹状細胞ワクチン療法についての概略の説明は下記をご覧ください。
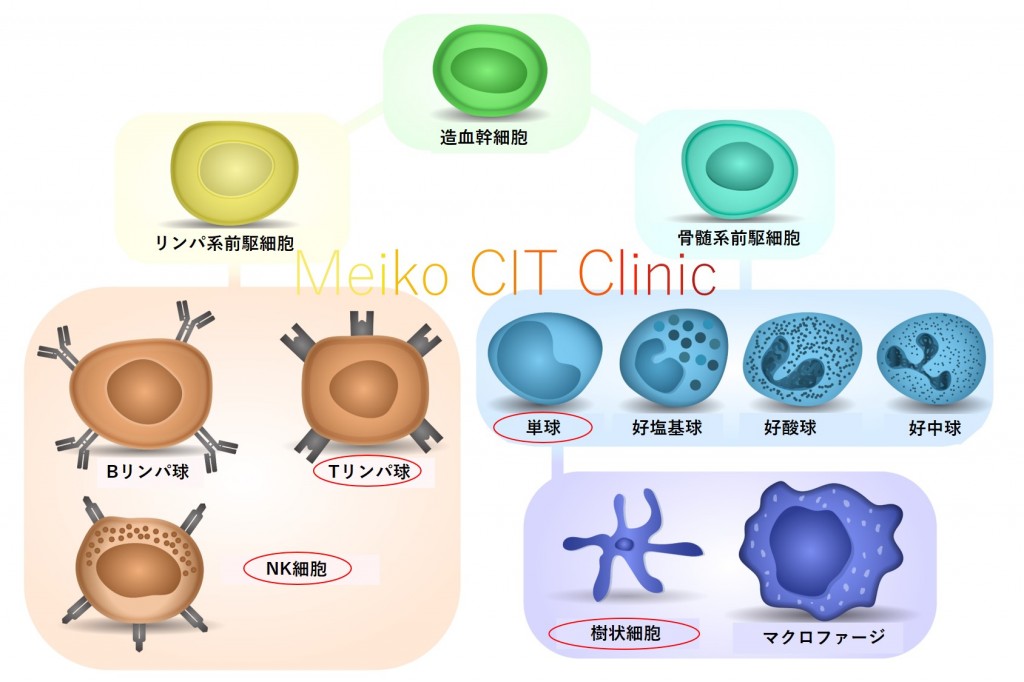
私達の血液には、赤血球、白血球、血小板の3つの系統の血球が存在しています。このうち、免疫に関係するのは白血球です。 白血球はさらに、「リンパ系」と「骨髄系」の2つに分けられます。「リンパ系」のうちがんの免疫で重要なのは「Tリンパ球」と「NK(ナチュラルキラー)細胞」です。「骨髄系」のうちがんの免疫で重要なのは「樹状細胞」です。「樹状細胞」は図のように元々は「単球」という白血球がもとになり、これが“分化”することによってできてきます。
白血球の分類
樹状細胞という白血球の名前はあまり聞き慣れないものと思いますが、1973年にカナダ人であるRalph Marvin Steinman教授によって発見された白血球の一種で、その名の通り表面が木の枝のような突起で覆われています[参考文献1]。樹状細胞を発見した功績により、Steinman教授は2011年にノーベル賞を受賞しました。
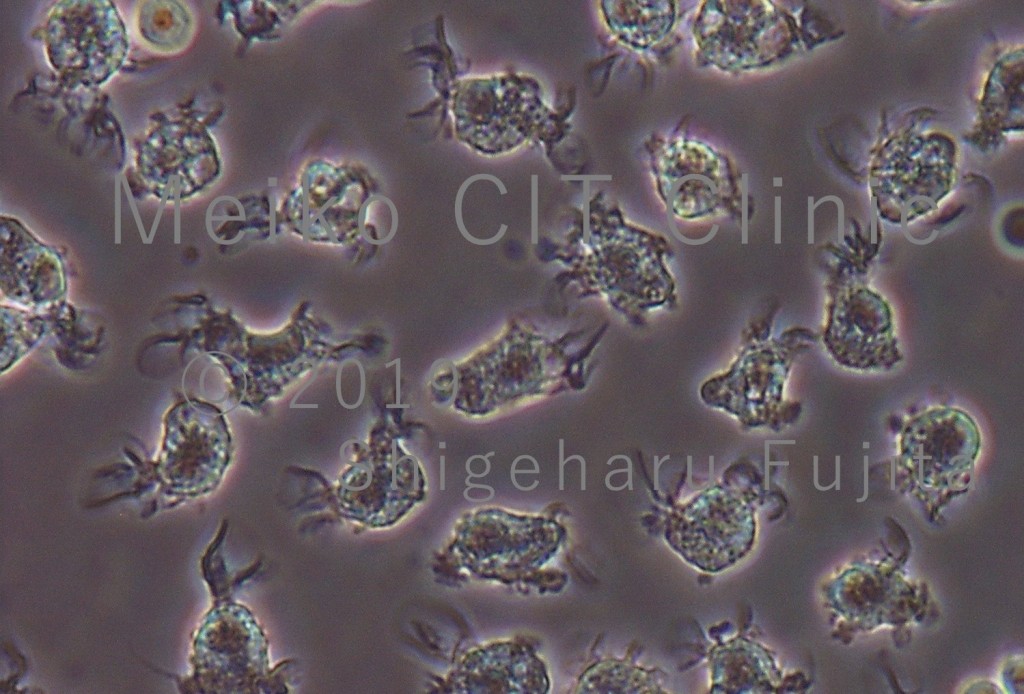
下記の写真は当院院長の藤田が2006年に東京大学医科学研究所の山下直秀教授のもとに配属していた時に、ボランティアの健康な方に東京大学医科学研究所附属病院でアフェレーシスを受けて頂き、テラ株式会社のご協力のもとで末梢血から分離して頂いた大量の単球を、理研横浜研究所 免疫・アレルギー科学総合研究センター(RCAI)樹状細胞機能研究チームの佐藤克明博士(現 宮崎大学医学部教授)のご指導の下で培養して分化させた樹状細胞の光学顕微鏡写真です。木の枝のような突起が多数みられ、非常にユニークな形をしていることがお分かりになると思います。
樹状細胞
実は、樹状細胞は免疫系の中核を担う“司令塔”とも呼ばれる非常に重要な細胞であり、樹状細胞はまずがん細胞を貪食(どんしょく)して自分の中で消化(プロセッシング)をして、こなごなになったがん細胞のタンパク質の一部(ペプチド)を、体の中にあってはならない悪いものの“目印”として自分の表面に出してきます。悪いものの“目印”して使われているタンパク質の一部(ペプチド)は「抗原」と呼ばれていて、自分の表面に抗原を出すことは「抗原提示」と呼ばれています。 樹状細胞は“司令塔”として、Tリンパ球に抗原を教育します。がんの“目印”をしっかり教え込まれたTリンパ球は“兵士”として樹状細胞によって活性化され、大量に増殖し、全身を循環して、同じ抗原を持ったがん細胞を見つけ出し、狙い撃ちにして殺します。免疫細胞は目が見えるわけではないのですが、その代わりに「抗原」を識別することによってがん細胞を見つけ出し、それだけをターゲットにして精確に殺傷することができるのです[参考文献2]。 樹状細胞の抗原提示の能力は体の免疫細胞の中で最強であることが知られています。Tリンパ球はさらに詳しく言うと「ヘルパーTリンパ球」と「キラーTリンパ球」に分けられるのですが、樹状細胞は自身が貪食してとりこんだ抗原をもとにヘルパーTリンパ球とキラーTリンパ球のどちらをも同時に活性化することができるのです。これは樹状細胞が「クロスプレゼンテーション」と呼ばれる特殊な抗原提示能力を兼ね備えているからであり、このような“プロフェッショナルな”抗原提示ができる免疫細胞は、白血球の中でも樹状細胞しかありません[参考文献3]。
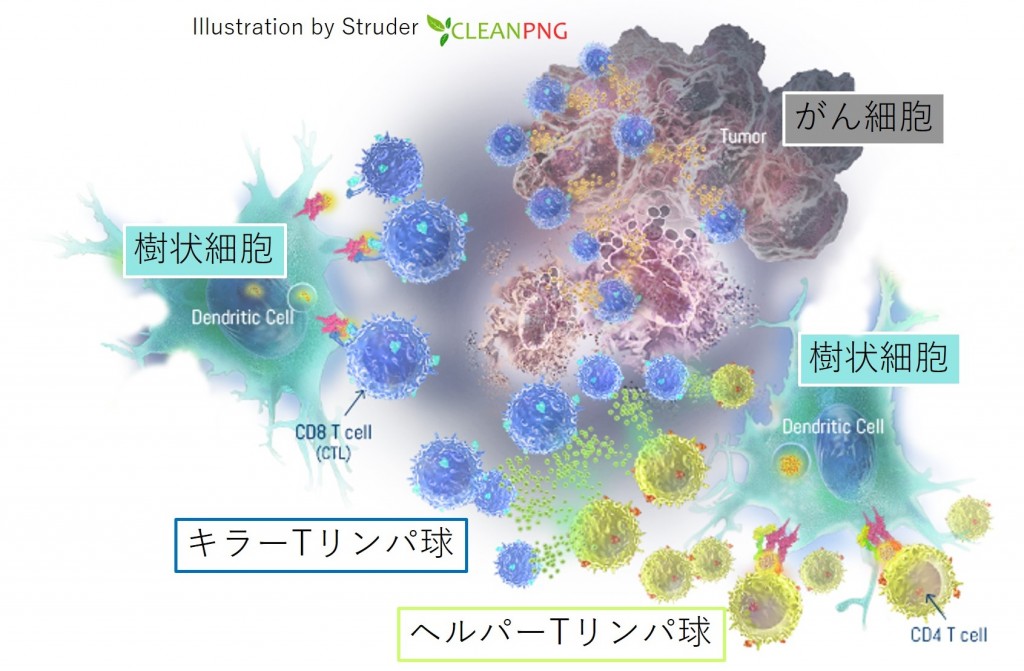
樹状細胞はヘルパーTリンパ球とキラーTリンパ球を同時に活性化できる
まず、「アフェレーシス」で体の中の単球を大量に採取し、体外で培養して樹状細胞に分化させ、この樹状細胞にがん細胞の抗原を覚えさせ、そして体に注射します。樹状細胞は体の中でTリンパ球にがんの抗原を教育し、Tリンパ球は樹状細胞によって活性化されて大量に増殖し、体を循環してがん細胞を見つけ出して殺傷します。
つまり、最強の抗原提示の能力を持つ樹状細胞によって、がんを体の免疫に覚えさせ、Tリンパ球ががんをターゲットにして戦うのです。これは「ワクチン」の原理に他ならないため、この治療法は「樹状細胞ワクチン」と呼ばれているのです。
以上のことから、樹状細胞ワクチン療法では、
①まず初めに「アフェレーシス」を行って大量の単球を採取すること
②次にTリンパ球を活性化させる能力の高い樹状細胞に分化させること
③最後に攻撃目標として最適ながんの「抗原」を樹状細胞に覚えさせること
の3点が、治療の効果を左右する非常に重要な鍵となることが分かります。これらを全て満足しているのが、本邦が世界に誇る、東京大学医科学研究所発のベンチャー企業のテラ株式会社の「WT1ペプチドパルス樹状細胞」であるといえます。
なお、東京大学医科学研究所の臨床研究からテラ株式会社の樹状細胞ワクチン療法の発展の歴史についてさらに詳しく知りたい方は下記をご参照ください。
テラ株式会社は、東京大学医科学研究所の山下直秀教授の下で行われた悪性黒色腫及び甲状腺癌に対する樹状細胞ワクチン療法の臨床研究を技術基盤とし[参考文献4,5]、2004年から悪性腫瘍を対象とした樹状細胞ワクチン療法の研究開発を行い、2005年にセレンクリニック東京にテラ株式会社の技術が導入され、以降、セレンクリニックグループおよび提携医療機関において、約12,000人を超える(2018年12月末時点)がんの患者様に樹状細胞ワクチン療法を中心とした免疫療法が行われてきました。
樹状細胞に提示させるがん抗原としては、大阪大学の杉山治夫教授が開発された、がん細胞に広く異常発現が認められる「Wilms腫瘍(Wilms’tumor 1; WT1)タンパク」の抗原として認識される部分を人工的に再合成した「WT1ペプチド」の有用性が高いことが世界的に認められており[参考文献6~8]、セレンクリニックグループではWT1ペプチドをがんの抗原として樹状細胞に提示させた「WT1ペプチドパルス樹状細胞」による免疫療法を行い、その臨床効果がセレンクリニック名古屋院長の小林正学博士を中心に多数の国際学術雑誌に発表されました[参考文献9~14]。WT1ペプチドについてはさらに、キラーTリンパ球を活性化可能なペプチド(クラスIペプチド)とヘルパーTリンパ球を活性化可能なペプチド(クラスIIペプチド)を同時に樹状細胞に抗原提示させることが可能となり、キラーTリンパ球とヘルパーTリンパ球の双方の抗腫瘍免疫力が統合された形での臨床効果については、2014年8月に東京慈恵会医科大学の小井戸薫雄教授から報告がなされています[参考文献15]。
さらに2016年12月、テラファーマ株式会社が和歌山県立医大学の山上裕機教授と共同で、標準療法不応進行膵がんに対する抗がん剤(S-1)併用WT1ペプチドパルス樹状細胞ワクチン(TLP0-001)の安全性・有効性を検討する、本邦初となる医師主導治験の実施に係る契約を締結し、独立行政法人医薬品医療機器総合機構(PMDA)に治験計画届書が提出され、2017年 3 月より二重盲検ランダム化比較試験が開始され、中間解析の結果、安全性データの評価を行った効果安全性評価委員会から治験継続について承認されたため、和歌山県立医科大学は本治験を多施設共同研究に展開するための変更届書をPMDAに提出し、本治験の実施医療機関は 11 医療機関に増え、樹状細胞ワクチンの再生医療等製品としての承認取得が目指されています。
なお、米国では既に2010年4月に、進行前立腺癌に対してDendreon株式会社の樹状細胞を含む細胞製剤である「シプリューセル-T(Sipuleucel-T)」が第Ⅲ相臨床試験を経て、世界初の免疫細胞製剤として「プロベンジ(Provenge)」との薬品名で米国食品医薬品局 (FDA) に承認されています[参考文献16]。
<参考文献>
活性化Tリンパ球療法

癌細胞を攻撃するTリンパ球
厚生労働省関東信越厚生局 認可2019年2月26日:再生医療等提供計画番号PC3180253 厚生労働省関東信越厚生局 認可2020年1月8日:再生医療等提供計画番号PC3190186
24mL(採血管3本分)の採血を行い、2週間の培養を行って、活性化したTリンパ球を数百倍まで大量増殖させて体内に点滴で戻す治療です。Tリンパ球は体内で“兵隊”の役割を果たし、ヘルパーTリンパ球が様々な因子(サイトカイン)を出して免疫を活性化させ、キラーTリンパ球(細胞傷害性Tリンパ球)ががん細胞を殺傷します。樹状細胞ワクチン療法と比較すると、Tリンパ球にがんの目印である「がん抗原」を覚えさせて標的にするものではないので、がん細胞を攻撃する以外のTリンパ球も増えますが、体全体の免疫が高まります。末梢血の採血だけでTリンパ球の培養ができるため、全身状態が悪い場合でもお受けになれます。抗がん剤などで白血球の数が減ってしまった場合などでも、樹状細胞ワクチン療法に活性化Tリンパ球療法を併用することによって、抗腫瘍免疫の効果を高めることができます。
◆がんの活性化Tリンパ球療法を詳しくお知りになりたい患者様は医療相談(初回無料)を随時行っておりますのでお電話やインターネットでご予約の上、お気軽にご相談下さい。
活性化リンパ球療法についての概略の説明は下記をご覧ください。
1980年代初め、米国国立癌研究所(National Cancer Institute ; NCI)のSteven A. Rosenberg博士によってリンホカイン活性化キラー細胞(lymphokine-activated killer cell ; LAK)療法が開発されました[参考文献1, 2]。LAK細胞と高用量のインターロイキン-2(IL-2)の併用投与は、腫瘍の縮小や時には進行癌の完全寛解をももたらし、マウスモデルおよびヒトの双方においてLAK細胞が腫瘍内に局在することが証明されました[参考文献3, 4]。しかし、高用量のIL-2の投与によって重篤な副作用もみられたため、LAK療法に対する期待は徐々に減退することとなっていきました。
1980年代後半、関根暉彬博士(GCリンフォテック社会長)はLAK療法を改良し、活性化Tリンパ球療法(または活性化自己リンパ球療法)を開発されました[参考文献5]。活性化Tリンパ球はLAK細胞と違い、IL-2だけではなくTリンパ球のT細胞受容体(CD3)に対する抗体も使うことで2000倍までTリンパ球を増殖させることに成功し、LAK療法よりも安全に治療を行えるようになりました[参考文献5,6]。
関根暉彬博士が国立がんセンター研究所の共通実験室室長として在任時に、術後肝細胞がんに対する活性化Tンパ球療法の再発予防効果を世界で初めて明らかにし、その結果が英国の医学誌「The Lancet」に掲載されました。150人の肝細胞がん術後の患者様を対象としたランダム化比較試験で、活性化Tリンパ球療法が術後のがんの再発を予防する効果を持つことが、無作為の統計学的データによって科学的に証明されたのです [参考文献7]。
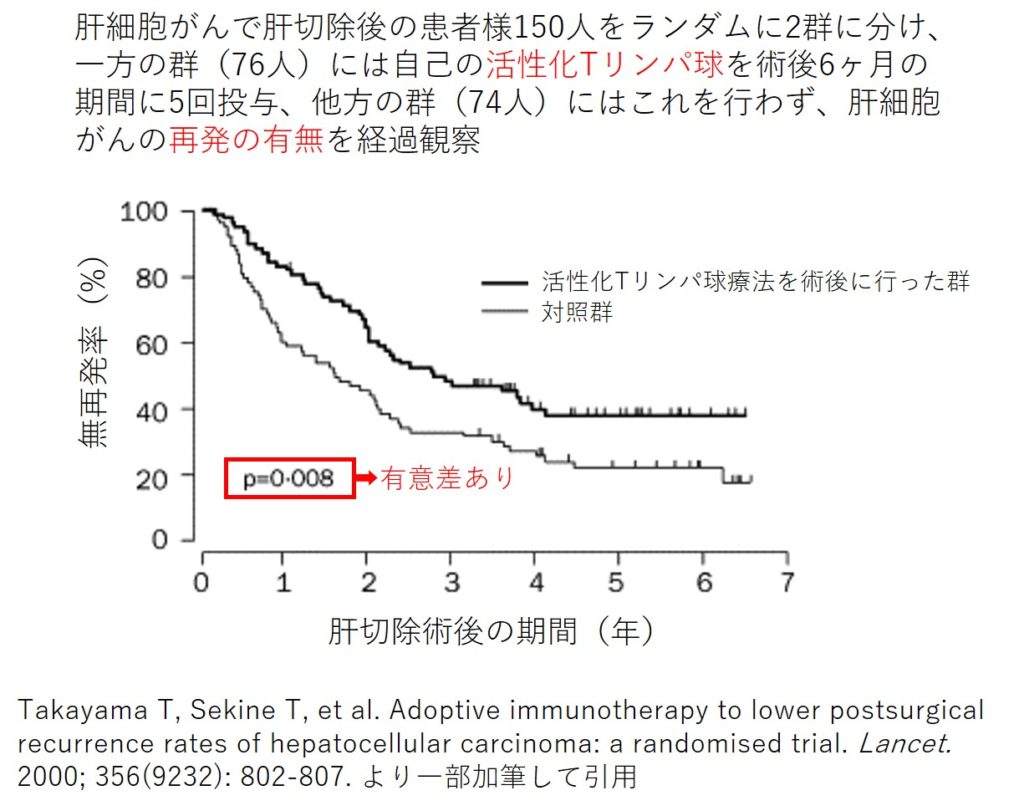
活性化Tリンパ球療法の肝細胞がんの術後再発に対する効果を証明した関根らのランダム化比較試験
樹状細胞ワクチンは、がんの抗原をTリンパ球に教育し、Tリンパ球のがんに対する特異的な攻撃反応を誘発します。しかし、免疫力が低下しているがんの患者様はTリンパ球数も少なくなっていることが多いため、重篤な副作用なく安全に投与できる活性化Tリンパ球と樹状細胞ワクチンを併用する複合免疫療法が望ましいと考えられています。 活性化Tリンパ球と樹状細胞ワクチンの併用で相乗的な治療効果がもたらされることが期待されますが、実際に悪性黒色腫の患者様に対する活性化リンパ球と樹状細胞ワクチンを用いた複合免疫療法の効果が、後藤重則博士(瀬田クリニックグループ 医療法人社団滉志会理事長)の主導された臨床試験によって明らかにされています [参考文献8]。
<参考文献>
- Grimm EA, Rosenberg SA, et al. Lymphokine-activated killer cell phenomenon. Lysis of natural killer-resistant fresh solid tumor cells by interleukin 2-activated autologous human peripheral blood lymphocytes. J Exp Med 1982; 155: 1823-1841.
- Rosenberg SA et al. Observations on the systemic administration of autologous lymphokine-activated killer cells and recombinant interleukin-2 to patients with metastatic cancer. N Engl J Med 1985; 313: 1485-1492.
- Keilholz U et al. Regional adoptive immunotherapy with interleukin-2 and lymphokine-activated killer (LAK) cells for liver metastases. Eur J Cancer 1994; 30: 103-105.
- Kjærgaard J et al. Biodistribution and tumor localization of lymphokine-activated killer T cells following different routes of administration into tumor-bearing animals. Cancer Immunol Immunother 2000; 48: 550-560.
- 関根暉彬 固層化CD3抗体により活性化したT Cell(CD3-LAK)を用いた養子免疫療法[Sekine T. Expansion of peripheral blood lymphocytes and tumorinfiltrating lymphocytes stimulated with immobilized anti-CD3 antibody for use in adoptive immunotherapy]. Biotherapy 1990; 4: 1606-1613.
- Sekine T, et al. A feasible method for expansion of peripheral blood lymphocytes by culture with immobilized anti-CD3 monoclonal antibody and interleukin-2 for use in adoptive immunotherapy of cancer patients. Biomed Pharmacother 1993; 47: 73-78.
- Takayama T, Sekine T, et al. Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: a randomised trial. Lancet 2000; 356: 802-807.
- Goto S et al. Combined immunocell therapy using activated lymphocytes and monocyte-derived dendritic cells for malignant melanoma. Anticancer Res 2005; 25: 3741-3746.
NK細胞療法

NK細胞
厚生労働省関東信越厚生局 認可2019年2月26日 更新2020年2月4日:再生医療等提供計画番号PC3180252
24mL(採血管3本分)の採血を行い、2週間の培養を行って、NK(ナチュラルキラー)細胞を数百倍まで大量増殖させて体内に点滴で戻す治療です。Tリンパ球は樹状細胞から「がん抗原」の情報に基づく指令を受けて精密な標的攻撃を行うのに対し、NK細胞は何も指令を受けずに自らがん細胞を攻撃します。Tリンパ球のように教育を受けて後から攻撃能力をつける免疫を「獲得免疫」といい、NK細胞のように何も教育を受けなくてももともと備わった力として敵を攻撃できる免疫を「自然免疫」といいます。NK細胞は、「がん抗原」というがんの目印自体を隠してTリンパ球からの攻撃を逃れているがん細胞を見つけ出して殺傷します。また、NK細胞は抗体が結合したがん細胞を認識して攻撃する「抗体依存性細胞傷害(antibody-dependent cellular cytotoxicity ; ADCC) 」という能力があるため、例えばハーセプチンなどの抗体医薬の抗がん剤と共に用いると相乗効果が得られます。さらに最近では、NK細胞は、体に様々な影響を及ぼし加齢性疾患を引き起こす「老化細胞(senescent cell)」を殺傷する能力があることも分かってきました。このようなことから、NK細胞はがんの免疫療法のみならず、アンチエイジング医療の分野でも大きな注目を浴びています。
◆東京大学医科学研究所発バイオベンチャー企業のテラ株式会社の培養技術でNK細胞を培養します。
◆がんのNK細胞療法を詳しくお知りになりたい患者様は医療相談(初回無料)を随時行っておりますのでお電話やインターネットでご予約の上、お気軽にご相談下さい。
NK細胞療法についての概略の説明は下記をご覧ください。
ナチュラルキラー(natural killer ; NK)細胞は、1968年にスウェーデンのKarl-Erik Hellström・Ingegerd Hellström博士夫妻によってがん細胞を標的として攻撃するリンパ球の一種として初めて報告され、さらに1975年にRolf Kiessling教授やRonald B. Herberman教授によって、抗原の認識を必要とせずに初期段階でがん細胞を自然に殺傷できる“ナチュラルキラー(生まれつきの殺し屋)”であるという特徴が明らかにされました[参考文献1~3]。樹状細胞から抗原の教育を受けて初めてがん細胞を攻撃できるようになるTリンパ球とは異なり、NK細胞はそれ自身が何も教育を受けなくても生まれながらにしてがん細胞を殺傷できる能力を持つことから、がんに対する有望な細胞療法として期待が寄せられるようになりました[参考文献4]。
NK細胞がどうして抗原の教育を受けずにがん細胞を認識できるのかは、「NKG2D(natural killer group 2D)」という受容体が鍵を握っていることが明らかになってきました[参考文献5]。また、NK細胞は、外敵とみなされる異物に対する抗体(免疫グロブリン ; Ig)が付着した細胞を見分けて殺傷することもでき、このメカニズムは「抗体依存性細胞傷害(antibody-dependent cell-mediated cytotoxicity ; ADCC)」と呼ばれています[参考文献6]。 そしてNK細胞は、「パーフォリン」・「グランザイムB」という分子でがん細胞を直接傷害したり、「Fasリガンド」・「TRAIL (TNF-related apoptosis-inducing ligand)」という分子でがん細胞を自死(アポトーシス)に追いやったりして殺します。
がんの病状が進行すると、NK細胞の機能障害と細胞生存率低下がみられるようになり、これらは体全体のがんに対する免疫反応の低下を引き起こします。そこで、がんの患者様から採取したNK細胞を体外で大量に培養して活性化して体内に再び投与して、がんに対する強力な殺傷能力を回復させるNK細胞療法が試みられるようになりました。NK細胞療法により、さまざまながん種の患者様で、一部で完全寛解がみられたり、無病生存期間の延長がもたらされたりしたことが報告されています [参考文献7~10]。
さらに、NK細胞療法は、樹状細胞ワクチンなどの他の免疫療法と組み合わせることで効果が増強できると考えられています。NK細胞はがん細胞の早期での先天的な殺傷(自然免疫)を行いますが、がん細胞の標的とした長期にわたる免疫制御は樹状細胞によって腫瘍関連抗原(tumor-associated antigen ; TAA)の教育を受けたTリンパ球の後天的な攻撃(獲得免疫)によるものです。樹状細胞とNK細胞は相互に活性化し、がんを標的とするTリンパ球の反応を促進することも報告されています[参考文献11,12]。このようなことから、樹状細胞ワクチン療法とNK細胞療法による複合免疫療法で、がんに対する免疫(抗腫瘍免疫)がさらに促進されることが期待されています。
<参考文献>
- Hellström I, Hellström KE, et al. Cellular and humoral immunity to different types of human neoplasms. Nature 1968; 220: 1352-1354.
- Herberman RB, et al. Natural cytotoxic reactivity of mouse lymphoid cells against syngeneic and allogeneic tumors. II. Characterization of effector cells. Int J Cancer 1975; 16: 230-239.
- Kiessling R, Klein E, Pross H, Wigzell H. “Natural” killer cells in the mouse. II. Cytotoxic cells with specificity for mouse Moloney leukemia cells. Characteristics of the killer cell. Eur J Immunol 1975; 5: 117-121.
- Srivastava S, et al. Natural killer cell immunotherapy for cancer: a new hope. Cytotherapy 2008; 10: 775-783.
- Spear P, et al. NKG2D ligands as therapeutic targets. Cancer Immun 2013; 13: 8.
- Titus JA, et al. Human K/natural killer cells targeted with hetero-cross-linked antibodies specifically lyse tumor cells in vitro and prevent tumor growth in vivo. J Immunol 1987; 139: 3153-3158.
- Dahlberg CIM, et al. Natural Killer Cell-Based Therapies Targeting Cancer: Possible Strategies to Gain and Sustain Anti-Tumor Activity. Front Immunol 2015; 6: 605.
- Escudier B, et al. Immunotherapy with interleukin-2 (IL2) and lymphokine-activated natural killer cells: improvement of clinical responses in metastatic renal cell carcinoma patients previously treated with IL2. Eur J Cancer 1994; 30A: 1078-1083.
- Lister J, et al. Autologous peripheral blood stem cell transplantation and adoptive immunotherapy with activated natural killer cells in the immediate post-transplant period. Clin Cancer Res 1995; 1: 607-614.
- Ishikawa E, et al. Autologous natural killer cell therapy for human recurrent malignant glioma. Anticancer Res 2004; 24: 1861-1871.
- Kalinski P, et al. Natural killer-dendritic cell cross-talk in cancer immunotherapy. Expert Opin Biol Ther 2005; 5: 1303-1315.
- Reschner A, et al. Innate lymphocyte and dendritic cell cross-talk: a key factor in the regulation of the immune response. Clin Exp Immunol 2008; 152: 219-226.
厚生労働省関東信越厚生局 認可2018年11月8日 更新2020年2月4日:再生医療等提供計画番号PC3180169 厚生労働省関東信越厚生局 認可2018年1月7日:再生医療等提供計画番号PC3190177
免疫チェックポイント阻害薬

免疫チェックポイント
銘煌CITクリニック倫理審査委員会 承認2019年6月24日
当院では、樹状細胞ワクチンのTリンパ球活性化作用をさらに増強する働きをもつ「免疫チェックポイント阻害薬」について、ご相談に応じております。 詳しい説明は下記をご覧ください。
最近、がんの治療において「免疫チェックポイント阻害薬(Immune checkpoint inhibitor)」と呼ばれる種類の一連の新薬が登場し、世界中で注目されています。“チェックポイント”というのは、英語で“検問所”という意味です。免疫細胞が活性化して、病原体やがん細胞と戦うことはもちろん大切なことなのですが、しかし免疫細胞がいつまでも活性化され過ぎていると、今度は逆に自分の体を傷つけてしまうようなことになるので、要所要所で設けられた“チェックポイント”で免疫細胞が暴走し過ぎないようにブレーキをかけて通常の状態に戻す必要があります。これは元来私たちの体に備わった、免疫のバランスを維持するための絶妙なメカニズムです。 ところががん細胞はこのメカニズムを逆手に取って、たくみにがん免疫から逃れて生き延びているのです。がん細胞が様々な手を使ってがん免疫の監視機構から逃避するメカニズムは「がん免疫編集(Cancer immunoediting)」と呼ばれ[参考文献1]、がん免疫療法の効果を弱めてしまう要因となるため、大きな問題となってきました。

チェックポイント(検問所)
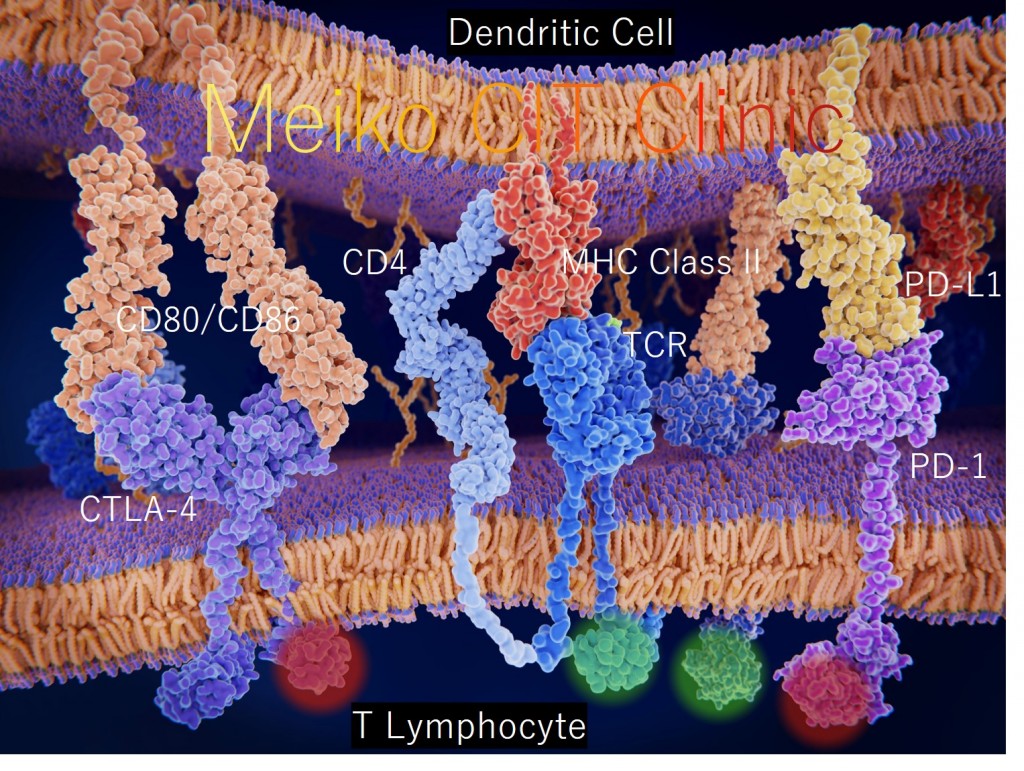
「CTLA-4(細胞傷害性Tリンパ球関連タンパク4:Cytotoxic T-lymphocyte-associated protein 4)」という分子は、Tリンパ球が活性化された後にTリンパ球の表面に現れてくる受容体として、1987年にフランスのJean-François Brunet博士らによって発見されました[参考文献2]。この「CTLA-4」について調べたところ、Tリンパ球が活性化した後に、いつまでも過剰な活性化状態が続き過ぎないように、Tリンパ球にブレーキをかける“チェックポイント”の役割をする分子であることが分かりました。樹状細胞は初めにがん抗原をTリンパ球に教えてTリンパ球を活性化させるのですが、その一方で「CTLA-4」にぴったりと結合できる分子を自分の上に発現しており、Tリンパ球があまり活性化し過ぎないように、樹状細胞は後になってTリンパ球にブレーキをかけて攻撃する力を抑えてしまうのです。米国のJames Patrick Allison教授らは、このTリンパ球の「CTLA-4」に結合してブレーキを外してくれる抗体をがんのマウスに投与したところ、樹状細胞からの抑制がブロックされて、Tリンパ球が活性化状態を維持することができるようになり、がんが治療できるということを証明しました[参考文献3]。こうして、抗体でできた薬であるイピリムマブ(商品名:ヤーボイ)が誕生し、Allison教授は2018年にノーベル賞を受賞しました。ヤーボイはこの他にも、「CTLA-4」を表面にたくさん発現していてがん免疫を抑えてしまう「抑制性Tリンパ球(Treg)」に打撃を与えるという作用もあり、これによってもがん免疫を上げる優れた効果があることが明らかになりました[参考文献4]。
一方、「PD-1(プログラム細胞死受容体1:Programmed Death-1)」という分子は、Tリンパ球が活性化した後にTリンパ球の表面に現れてくる受容体として、日本の京都大学の本庶佑教授らによって発見されました[参考文献5]。この「PD-1」について調べたところ、これもTリンパ球が活性化した後に、いつまでも過剰な活性化状態が続き過ぎないように、Tリンパ球にブレーキをかける“チェックポイント”の役割をする分子であることが分かりました。がん細胞は活性化したTリンパ球に攻撃されると、「PD-1」にぴったりと結合できる分子を自分の上に発現して、Tリンパ球が自分を攻撃できないようにしてしまいます。がん細胞がみずからを守る巧妙な戦略によって、活性化したTリンパ球がブレーキをかけられて攻撃する力を失ってしまうのです[参考文献6]。本庶教授らがこのTリンパ球の「PD-1」に結合してブレーキを外してくれる抗体を作製したところ、がん細胞からの抑制がブロックされて、Tリンパ球は活性化状態を取り戻して、またがん細胞を攻撃し続けることができるようになることが証明されました。こうして、抗体でできた薬であるニボルマブ(商品名:オブジーボ)が誕生し、本庶教授は2018年にノーベル賞を受賞しました。
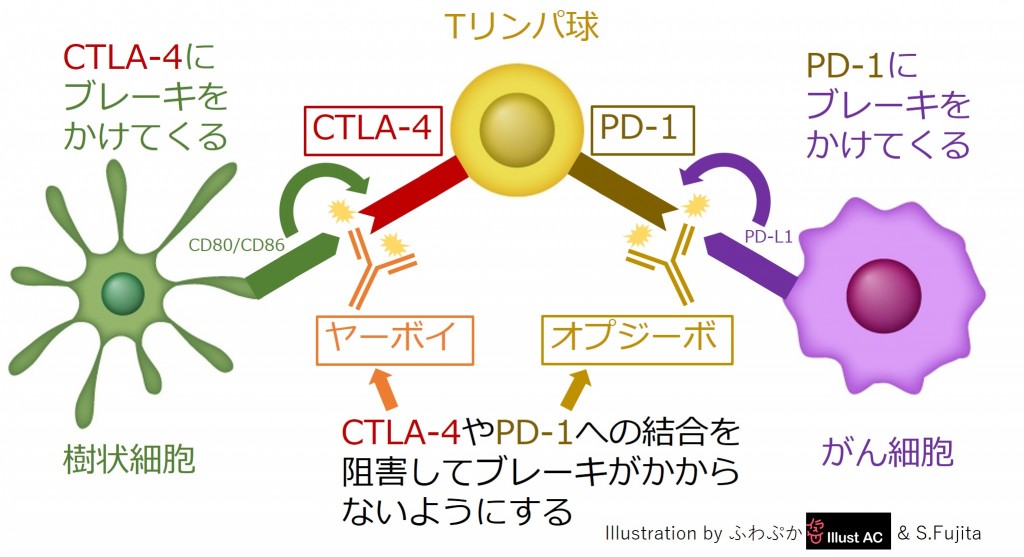
Tリンパ球のブレーキであるCTLA-4とPD-1をブロックするヤーボイとオプジーボ
このようにして、Tリンパ球にかかってしまったブレーキを外してがん免疫の活性を強く保ってくれるのが「免疫チェックポイント阻害薬」です。「免疫チェックポイント阻害薬」は、単に増殖している細胞を殺すという作用のみだったこれまでの抗がん剤とは全く違って、体の中の免疫の力によってがんを治すことができることを明確に示し、免疫療法の歴史を大きく転換させました。「免疫チェックポイント阻害薬」の登場は、世界に衝撃を与え、まさに免疫療法の新しい時代を切り拓く“ブレークスルー”となったのです。
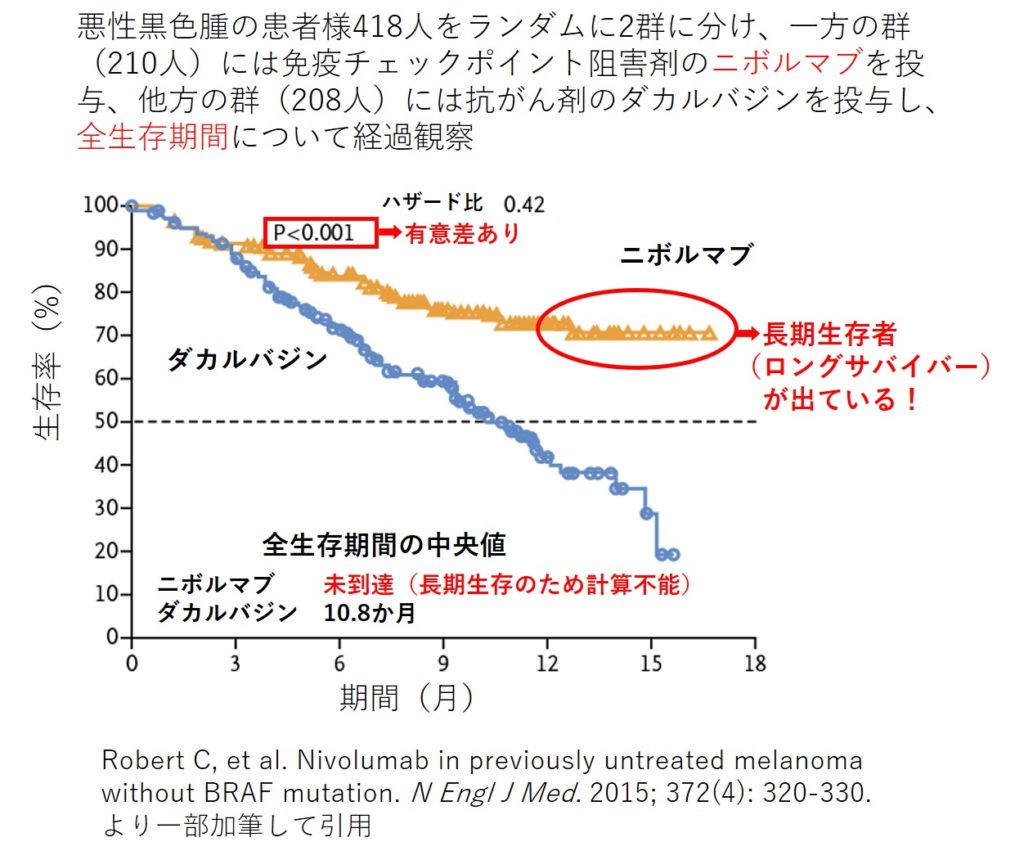
免疫チェックポイント阻害剤ニボルマブの方が抗がん剤ダカルバジンよりも全生存期間を延長したことを証明したCheckMate066試験
当院で行う樹状細胞ワクチン療法では、樹状細胞が「WT1」などのがん抗原を体の中でTリンパ球に教えて活性化させて、がん細胞に対するTリンパ球のがん免疫を誘導します。しかし、活性化したTリンパ球の表面に現れた「CTLA-4」に結合する分子を樹状細胞が持っていて、Tリンパ球が過剰に活性化し続けないように逆に抑制をかけてしまったり、活性化したTリンパ球の表面に現れた「PD-1」に結合する分子をがん細胞が出して、Tリンパ球の活性を失わせて攻撃から逃れてしまったりします。このことは、樹状細胞ワクチン療法によってせっかくアクセルがかかったがん免疫が弱まってしまうことにつながります。ここでヤーボイ・オブジーボを併用すれば、「CTLA-4」や「PD-1」に結合して、樹状細胞やがん細胞がTリンパ球の攻撃力を弱めてしまう作用をブロックしてくれて、Tリンパ球にかけられてしまったブレーキを外せることになります。つまり、樹状細胞はがん免疫に“アクセルをかけ”、ヤーボイ・オブジーボはがん免疫の“ブレーキを外す”働きをすると言うことができます。Tリンパ球にかかってしまった抑制を取り除くことで、樹状細胞ワクチン療法によって誘導されたがん免疫が最大限に働くことができるようになると考えられます。
ただし、ヤーボイ・オブジーボなどの「免疫チェックポイント阻害薬」は“諸刃の剣”でもあって、大変重い副作用もあります。「免疫チェックポイント阻害薬」は、Tリンパ球のブレーキを外す働きによって、Tリンパ球を活性化させ過ぎて暴走させてしまうことがあり、Tリンパ球ががんと戦うだけでなく、過剰な免疫力で自分の体まで傷つけてしまう、自己免疫の病態のような副作用が現れるリスクがあります。これまでの抗がん剤などではみられなかった「免疫チェックポイント阻害薬」のこのような独特の副作用は、「免疫関連有害事象(immune-related adverse event ; irAE)」呼ばれており、大変危険な副作用です。そのため、「免疫チェックポイント阻害薬」はがん治療に効果があるからといってただ安易に使えるようなお薬ではなく、「免疫関連有害事象」に厳重に注意しながら、非常に慎重に使う必要があるお薬なのです。当院では免疫チェックポイント阻害薬についてご相談をお受けしておりますが、標準療法を行って下さる主治医の先生のご理解とご承諾が頂けた場合のみに限り、緊密な診療連携をとって治療を行います。
なお、免疫チェックポイント阻害薬を用いた複合免疫療法についてさらに専門的に知りたい方は下記をご参照ください。
イピリムマブ(Ipilimumab)は小野薬品工業株式会社とBristol-Myers Squibb株式会社(開発元であったMedarex株式会社を買収)によって開発されたCTLA-4分子に対する抗体医薬(ヒトIgG1型モノクローナル抗体)です。リンパ節において樹状細胞はTリンパ球のCTLA-4に結合するCD80/CD86という分子を介して活性化Tリンパ球(エフェクターTリンパ球)の抑制的調節を行いますが、イピリムマブはTリンパ球のCTLA-4分子に結合して樹状細胞のCD80/CD86分子との結合を遮断することによってTリンパ球が陥った抑制状態を解除し、Tリンパ球の活性化と増殖を再び促進して細胞傷害活性を増強させます。また、イピリムマブは、CTLA-4分子を高発現している抑制性Tリンパ球(Treg)の機能を低下させ、さらに「抗体依存性細胞障害作用(Antibody-dependent cellular cytotoxicity; ADCC)」を介して腫瘍浸潤マクロファージによるTreg細胞の貪食を誘導し、Treg細胞の数を減少させることによって腫瘍免疫反応を亢進させると考えられています。イピリムマブの商品名は“Your”+“Voyage”の頭文字をそれぞれ取って「ヤーボイ(Yervoy)」と命名されたとのことです。総数217人のStageⅢまたはⅣ悪性黒色腫患者様を対象としてイピリムマブの第Ⅱ相試験が行われ、0.3mg/kg投与群、3mg/kg投与群、10mg/kg投与群が1:1:1の人数比で比較され、導入療法フェーズではイピリムマブが3週間隔で4回投与され、維持療法フェーズではイピリムマブが3ヶ月に1回投与されました。2010年の報告では奏効率(Objective response rate; ORR =(CR+PR)÷患者総数×100%)[註: CRは完全奏功(Copmlete response)、PRは部分奏功(Partial response)の意]は0.3mg/kg投与で0%(95%信頼区間0.0~4.9%)、3mg/kg投与で4.2%(95%信頼区間 0.9~11.7%)、10mg/kg投与で11.1%(95%信頼区間 4.9~20.7%)でした[参考文献7]。
ニボルマブ(Nivolumab)は小野薬品工業株式会社とBristol-Myers Squibb株式会社(開発元であったMedarex株式会社を買収)によって開発されたPD-1分子に対するヒト抗体医薬(IgG4型モノクローナル抗体)です。腫瘍微小環境(Tumor microenvironment)においてがん細胞はTリンパ球のPD-1に結合するPD-L1という分子を介して活性化Tリンパ球の機能を阻害し免疫逃避を行いますが、ニボルマブはTリンパ球のPD-1分子に結合して腫瘍細胞のPD-L1分子との結合を遮断することによってTリンパ球が陥った抑制状態を解除し、Tリンパ球の抗腫瘍効果を再び増強させます。ニボルマブの商品名は“Optimal”+“PD-1”+“Nivolumab”の頭文字をそれぞれ取って「オプジーボ(Opdivo)」と命名されたとのことです。大腸がん14例、悪性黒色腫10例、前立腺がん8例、非小細胞肺がん6例、腎細胞がん1例の総数39人の患者様を対象としてニボルマブの第Ⅰ相試験が行われ、大腸がん1例(3mg/kg, 5回投与)で完全奏功(Complete response; CR)、悪性黒色腫1例(10mg/kg, 11回投与)と腎細胞がん1例(10mg/kg, 3回投与)で部分奏功(Partial response; PR)が確認されたことが2010年に報告されました[参考文献8]。非小細胞肺がん122例、悪性黒色腫104例、腎細胞がん34例、大腸がん19例、前立腺がん17例の総数296人の患者様を対象としてニボルマブの第Ⅰ相試験が行われ、奏効率(ORR)は非小細胞肺がんで18%、悪性黒色腫で28%、腎細胞がんで27%であったことが2012年に報告されました[参考文献9]。一方で、ニボルマブは従来の殺細胞性抗がん剤や分子標的薬とは明確に異なる免疫作用機序を持つため、間質性肺疾患、甲状腺炎、下垂体炎、肝炎、白斑等の特徴的な「免疫関連有害事象(Immune-related adverse event; irAE)」が報告され、このうち特に間質性肺疾患については3人(患者総数の1%に相当)の死亡がみられ注意が喚起されました[参考文献9]。ニボルマブは種々の悪性腫瘍の中でも悪性黒色腫及び非小細胞肺がんに対する大規模臨床試験が先行して行われて2015年に入って相次いで報告がなされました。総数418人の悪性黒色腫患者様を対象としたニボルマブの第Ⅲ相試験であるCheckMate066試験では、抗がん剤のダカルバジン(Dacarbazine)を対照として全生存期間(Overall survival; OS)の中央値はダカルバジン群で10.8ヶ月、ニボルマブ群で未到達(長期生存のため計算不能)、1年全生存率(Overall survival rate; OSR)はダカルバジン群で42%、ニボルマブ群で73%であり、統計学的に有意な生存期間の延長がみられました(ハザード比0.42, P値<0.001)[参考文献10]。総数272人の扁平上皮非小細胞肺がん患者様を対象としたニボルマブの第Ⅲ相試験であるCheckMate017試験では、抗がん剤のドセタキセル(Docetaxel)を対照として全生存期間(OS)の中央値はドセタキセル群で6.0ヶ月、ニボルマブ群で9.2ヶ月、1年全生存率(OSR)はドセタキセル群で24%、ニボルマブ群で42%であり、統計学的に有意な生存期間の延長がみられました(ハザード比0.59, P値<0.001)[参考文献11]。総数582人の非扁平上皮非小細胞肺がん患者様を対象としたニボルマブの第Ⅲ相試験であるCheckMate057試験では、ドセタキセルを対照として全生存期間(OS)の中央値はドセタキセル群で9.4ヶ月、ニボルマブ群で12.2ヶ月、1年全生存率(OSR)はドセタキセル群で39%、ニボルマブ群で51%であり、統計学的に有意な生存期間の延長がみられました(ハザード比0.73, P値=0.002)[参考文献12]。これらの臨床試験等の結果に基づき、我が国ではまず、悪性黒色腫及び非小細胞肺がんに対してニボルマブの使用が保険承認となりました。さらに2015年にはこの後ニボルマブの腎細胞がんに対する大規模臨床試験の報告もなされました。総数821人の腎細胞がん患者様を対象としたニボルマブの第Ⅲ相試験であるCheckMate025試験では、抗がん剤のエベロリムス(Everolimus)を対照として奏効率(ORR)はエベロリムス群で5%、ニボルマブ群で25%、全生存期間(OS)の中央値はエベロリムス群で19.6ヶ月、ニボルマブ群で25.0ヶ月であり、統計学的に有意な生存期間の延長がみられました(ハザード比0.73, P値=0.002)[参考文献13]。この後もさらに多種類のがんでニボルマブの抗がん剤に勝る有効性が報告されることが続いています。このように、ニボルマブは単に細胞を殺す抗がん剤と全く違うメカニズムで本来生体に備わっているTリンパ球の抗腫瘍免疫を活性化させることによって悪性腫瘍を治癒に至らしめる可能性を秘めた、まさにがん免疫療法の歴史における画期的な薬といえるのです。
このように、イピリムマブとニボルマブは同じ免疫チェックポイント阻害薬であっても異なるメカニズムを持っており、CTLA-4阻害薬のイピリムマブは免疫応答の初期(プライミングフェーズ)にリンパ節でのTリンパ球活性化の増強を介して抗腫瘍免疫を高めると考えられ、PD-1阻害薬のニボルマブは免疫応答の晩期(エフェクターフェーズ)で腫瘍微小環境でのTリンパ球浸潤において抗腫瘍免疫を高めると考えられています[参考文献14]。イピリムマブとニボルマブは互いに免疫抑制を解除する機能を補い合う関係にあるため、これらを併用した「二重免疫チェックポイント遮断(Dual immune checkpoint blockade)療法」が試みられてきました。総数945人の未治療切除不能メラノーマ患者様を対象とした第Ⅲ相臨床試験である CheckMate067試験では、PD-1阻害薬ニボルマブ単独群、CTLA-4阻害薬イピリムマブ単独群、二剤併用群が1:1:1の人数比で比較され、2017年の報告では最小追跡期間36ヶ月で全生存期間(OS)の中央値は、二剤併用群で未到達(長期生存のため計算不能)、ニボルマブ単独群で37.6ヶ月、イピリムマブ単独群で19.9ヶ月でした(二剤併用群対イピリムマブ単独群でハザード比0.55, P値<0.001;ニボルマブ単独群対イピリムマブ単独群でハザード比0.65, P値<0.001)。3年生存率は二剤併用群で58%、ニボルマブ単独群52%、イピリムマブ単独群34%でした。なお、二剤併用群対ニボルマブ単独群の差に関しては有意ではなかったものの、奏効率(ORR)、全生存期間(OS)、無増悪生存期間(Progression-free survival; PFS)の全てについて、二剤併用群がニボルマブ単独群よりも改善する傾向が見られました。一方、Grade3または4の治療関連有害事象は、二剤併用群59%、ニボルマブ単独群21%、イピリムマブ単独群の28%でみられました[参考文献15]。このように、イピリムマブは単独使用よりもニボルマブとの併用効果が望まれるものと考えられましたが、一方で二剤併用とすると重篤な有害事象の倍増が認められ注意を要すると考えられました。また総数119人のDNAミスマッチ修復機構欠損(DNA mismatch repair–deficient; dMMR)または高頻度マイクロサテライト不安定性(microsatellite instability–high; MSI-H)を有する転移性大腸がん患者様を対象とした第Ⅱ相臨床試験であるCheckMate142試験では、ニボルマブ(3mg/kg)およびイピリムマブ(1mg/kg)が3週間隔で4回投与された後、ニボルマブ(3mg/kg)が2週間隔で投与されました。2018年の報告では中央値13.4カ月の追跡調査において、奏効率(ORR)は55%でした。また奏効には持続性が認められ、データカットオフ時点で奏功が得られた患者の94%で奏効が持続中でした。1年全生存率(OSR)は85%、全生存期間(OS)の中央値は未到達(長期生存のため計算不能)でした。Grade3または4の治療関連有害事象が32%みられました[参考文献16]。また総数94人の放射線照射を受けていない脳転移(腫瘍径0.5~3cm)を有する転移性悪性黒色腫患者様を対象とした第Ⅱ相臨床試験であるCheckMate204試験では、ニボルマブ(1mg/kg)およびイピリムマブ(3mg/kg)が3週間隔で4回まで投与された後、ニボルマブ(3mg/kg)が2週間隔で投与されました。2018年の報告では頭蓋内における臨床的有用率(Clinical benefit rate; CBR =(CR+PR+6ヶ月以上持続のSD)÷患者総数×100%)は57%でした[註: SDは安定(Stable disease)の意]。Grade3または4の治療関連有害事象が55%みられ、中枢神経系を含む有害事象が7%含まれていた[参考文献17]。なお、総数1096人の未治療の中~高リスクの進行腎細胞がん患者を対象とした第Ⅲ相臨床試験であるCheckMate214試験では、ニボルマブの二剤併用群と抗がん剤のスニチニブ群が1:1の人数比で比較され、前者はニボルマブ(3mg/kg)およびイピリムマブ(1mg/kg)が3週間隔で4回投与された後、ニボルマブ(3mg/kg)が2週間隔で投与され、後者はスニチニブ(50mg)が1日1回4週間にわたり投与された後、2週間休薬とするサイクルを継続しました。2018年の報告では追跡期間中央値25.2ヶ月で、18ヶ月全生存率(OSR)は二剤併用群75%、スニチニブ群60%でした。全生存期間(OS)の中央値は二剤併用群で未到達(長期生存のため計算不能)、スニチニブ群で26ヶ月でした(ハザード比0.63, P値<0.001)[参考文献18]。以上のように、ニボルマブとイピリムマブの二重免疫チェックポイント遮断療法は近年著しい成果によってエビデンスを蓄積しつつあります。
WT1ペプチド等のがん抗原を提示させた樹状細胞ワクチンを投与することによってTリンパ球の“アクセルが踏まれ”抗腫瘍免疫活性が増強されますが、活性化したTリンパ球の表面にはその後CTLA-4分子が発現し、これが樹状細胞表面のCD80/CD86分子に結合することで、Tリンパ球は活性化状態を維持できずに抑制されます。また活性化したTリンパ球の表面にはPD-1分子も発現しますが、これが腫瘍細胞表面のPD-L1分子と結合することで、Tリンパ球の活性化状態が失われて攻撃不能となり、腫瘍細胞はTリンパ球の攻撃を逃れてしまいます。このように樹状細胞がTリンパ球の活性化の持続を妨げたり、腫瘍細胞が活性化Tリンパ球の攻撃を妨げたりすることによって生じるがんの免疫逃避機構に対して、免疫チェックポイント阻害剤であるイピリムマブ・ニボルマブを投与することによって、それぞれCTLA-4分子へのCD80/CD86分子の結合およびPD-1分子へのPD-L1分子の結合が阻害され、活性化を妨げていた抑制性シグナルが入らなくなってTリンパ球の“ブレーキが外され”、Tリンパ球の腫瘍細胞に対する攻撃能力が再び回復します。このように樹状細胞ワクチンとイピリムマブ・ニボルマブを合わせて使用することによって、がん細胞を攻撃するTリンパ球の“アクセルを踏み、ブレーキを外す”戦略は、免疫学的観点からも合理的であると考えられ、樹状細胞ワクチンとイピリムマブ・ニボルマブの併用療法への期待が高まっています。樹状細胞ワクチンとCTLA-4・PD-1の二重チェックポイント遮断の相乗効果によって、リンパ節でのプライミングフェーズにおけるTリンパ球の抗腫瘍活性化と増殖が促進され、腫瘍微小環境におけるエフェクターフェーズでの抗腫瘍T細胞の活性の維持と殺腫瘍効果の増強がもたらされるものと考えられます。既に米国では2015年からDuke大学メディカルセンターにて再発性の悪性神経膠腫、星細胞腫、神経膠芽腫の患者様に対して樹状細胞ワクチンとニボルマブの併用療法の第Ⅰ相臨床試験(ClinicalTrials.gov.ID:NCT02529072)が行われています[参考文献19]。また2016年に総数48人のStageⅢまたはⅣの転移性悪性黒色腫患者様を対象とし、樹状細胞ワクチン治療終了後にイピリムマブ(3mg/kg)を3週間隔で4回投与した臨床試験の後ろ向き研究がオランダのRadboud大学メディカルセンターから報告されています。無増悪生存期間(PFS)率は、樹状細胞ワクチン治療後にイピリムマブを投与された患者様は1年で35%、2年で35%、樹状細胞ワクチン治療のみ受けたStageⅣ患者様は1年で7%、2年で3%でした。Grade3の免疫関連有害事象が19%の患者様で認められ、イピリムマブに関連した死亡が1人(2%)ありました。StageⅢ患者様の樹状細胞ワクチン治療後ではイピリムマブに対する臨床反応の効果が認められましたが、StageⅣ患者様の樹状細胞ワクチン治療後ではその効果は非常に限定されました[参考文献20]。さらに米国では2018年からH. Lee Moffitt 癌センター・研究所にて再発小細胞肺がん患者様に対する樹状細胞ワクチンとイピリムマブ・ニボルマブの併用療法の臨床試験が行われています。アデノウイルスベクターでp53遺伝子を導入してp53ペプチドを抗原提示できるようにした樹状細胞ワクチン(Ad.p53-DC)[参考文献21]にイピリムマブとニボルマブを併用する複合免疫療法の第Ⅱ相臨床試験(ClinicalTrials.gov.ID:NCT03406715)が行われています。導入療法フェーズでは3週間を1サイクルとして各サイクルの1日目にイピリムマブとニボルマブが投与され4サイクルまで繰り返されます。サイクル1の1日目と15日目、サイクル2の8日目にAd.p53-DCが投与されます。その後は維持療法フェーズとなり、4週間を1サイクルとして各サイクルの1日目にニボルマブが投与され、Ad.p53-DCが4週間隔でさらに3回投与されます[参考文献22]。 このように、世界で既に樹状細胞ワクチン療法と免疫チェックポイント阻害薬の複合免疫療法(Combinatorial immunotherapy; CIT)の臨床試験が進められているのです。
<参考文献>
- Dunn GP, et al. Cancer immunoediting: from immunosurveillance to tumor escape. Nat Immunol 2002; 3: 991-998.
- Brunet JF, et al. A new member of the immunoglobulin superfamily–CTLA-4. Nature 1987; 328: 267-270.
- Leach DR, et al. Enhancement of antitumor immunity by CTLA-4 blockade. Science 1996; 271: 1734-1736.
- Rowshanravan B, et al. CTLA-4: a moving target in immunotherapy. Blood 2017; blood-2017-06-741033.
- Ishida Y, Honjo T, et al. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J 1992; 11: 3887-3895.
- Keir ME, et al. PD-1 and Its Ligands in Tolerance and Immunity. Annu Rev Immunol 2008; 26: 677-704.
- Wolchok JD, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncol 2010; 11: 155-164.
- Brahmer JR, et al. Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates. J Clin Oncol 2010; 28: 3167-3175.
- Topalian SL, et al. Safety, activity, and immune correlates of anti–PD-1 antibody in cancer. N Engl J Med 2012; 366: 2443-2454.
- Robert C, et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372: 320-330.
- Brahmer JR, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015; 373: 123-135.
- Borghaei H, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015; 373: 1627-1639.
- Motzer RJ, et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373: 1803-1813.
- Sharpe AH, et al. The diverse functions of the PD1 inhibitory pathway. Nat Rev Immunol 2018; 18: 153–167.
- Wolchok JD, et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2017; 377: 1345-1356.
- Overman MJ, et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repair–deficient/microsatellite instability–high metastatic colorectal cancer. J Clin Oncol 2018; 36: 773-779.
- Tawbi HA, et al. Combined nivolumab and ipilimumab in melanoma metastatic to the brain. N Engl J Med 2018; 379: 722-730.
- Motzer RJ, et al. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378: 1277-1290.
- Archer G, et al. AVeRT: Anti-PD-1 monoclonal antibody (nivolumab) in combination with DC vaccines for the treatment of recurrent grade III and grade IV brain tumors. ClinicalTrials. gov 2015; https://clinicaltrials.gov/ct2/show/NCT02529072.
- Boudewijns S, et al. Ipilimumab administered to metastatic melanoma patients who progressed after dendritic cell vaccination. Oncoimmunology 2016; 5: e1201625.
- Chiappori AA, et al. INGN-225: a dendritic cell-based p53 vaccine (Ad.p53-DC) in small cell lung cancer: observed association between immune response and enhanced chemotherapy effect. Expert Opin Biol Ther 2010; 10: 983-991.
- Chiappori AA, et al. Combination immunotherapy with ipilimumab and nivolumab plus a dendritic cell based p53 vaccine (Ad.p53-DC) in patients with relapsed small cell lung cancer (SCLC). ClinicalTrials. gov 2018; https://clinicaltrials.gov/ct2/show/NCT03406715.
水素吸入療法

水素吸入療法
ハイセルベーターET100:電気分解方式、水素発生量約1,200±30mL/min 、水素純度99.99%
当院では水素吸入療法をご提供しています。これまでは市販の「水素水」などでごく微量な水素を摂取することしかできませんでしたが、医療機器の進歩により安全性も確立されて、大量の水素を直接吸入することができるようになりました。
水素は「酸化」の逆の反応である「還元」という作用によって、細胞のミトコンドリアを活性化し、Tリンパ球の活性を維持し、がんと戦う免疫力を高めます。
また、様々な疾患に対する水素の治療効果が明らかとなってきており、水素吸入療法の臨床試験がさかんに行われています。水素吸入療法はがん治療のみならず、アンチエイジングやスポーツ医学などの分野でも応用が広がっています。
当院では、業界最高水準の圧倒的な水素発生量を誇る、ヘリックスジャパン社の水素吸入器、ハイセルベーターET100を導入しております。その効果を是非クリニックで実感して下さい。
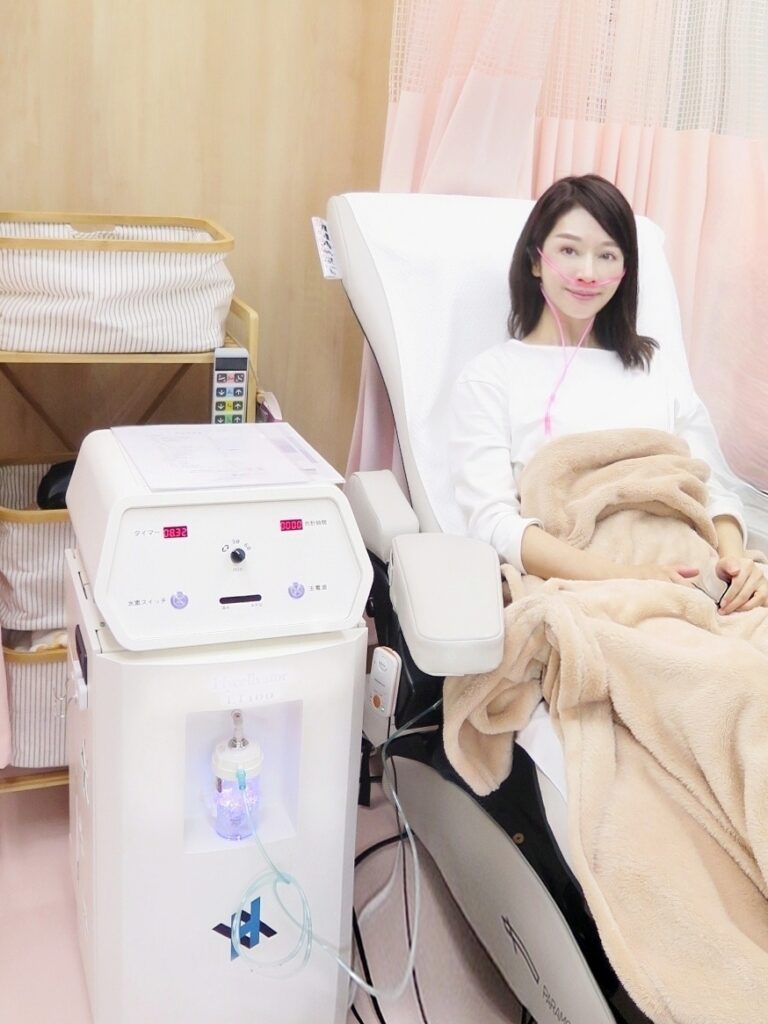
院内での水素吸入器ET100による水素吸入の様子
◆水素吸入療法のお試しをお考えの方は、体験吸入(初回1時間無料)を随時行っておりますのでお電話やインターネットでご予約の上、お気軽にご相談下さい。
◆当院では、ヘリックスジャパン社の 水素吸入器ET100(主に医療施設用)および 水素吸入器PF72(主に家庭用)のレンタルも行っており、ご自宅で毎日水素吸入療法をお受けになることも可能です。料金などの詳細についてはレンタル料金のご案内のページもご覧ください。水素吸入器レンタルをご希望される場合は、詳しくご説明致します。

水素吸入器ハイセルベーターET100